Le sulfure de zinc cubique (ZnS) est un matériau semi-conducteur II-VI bien connu, qui a suscité un vif intérêt en raison de sa large bande interdite, de son excellente transmission infrarouge et de ses propriétés de luminescence uniques. Il cristallise dans la structure blende de zinc, une forme cristalline prototype pour de nombreux autres semi-conducteurs. Grâce à sa transparence optique, sa haute qualité électronique et sa stabilité structurelle, le ZnS cubique est largement considéré comme un matériau à fort potentiel pour les semi-conducteurs, l’optique infrarouge et les dispositifs optoélectroniques avancés.
Qu'est-ce que le sulfure de zinc cubique ?
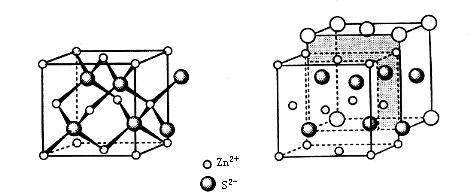
Le sulfure de zinc cubique est une forme de cristal de ZnS, composé d’atomes de soufre et de zinc formant chacun un réseau cubique à faces centrées. Les deux réseaux s’interpénètrent avec un déplacement relatif d’un quart de la diagonale du corps. Dans cette structure cristalline, les atomes de soufre sont disposés en empilement cubique serré, et les atomes de zinc occupent la moitié des vides tétraédriques formés par les atomes de soufre. Le ZnS cubique est le composé le plus représentatif de la structure blende du zinc ; c’est pourquoi cette structure est également appelée structure ZnS cubique.
Le sulfure de zinc (ZnS) est un composé inorganique pouvant être utilisé comme matériau semi-conducteur, matériau optique infrarouge et phosphore. Le ZnS est un semi-conducteur intrinsèque des groupes II à VI doté d’une large bande interdite et d’excellentes propriétés optiques. Il présente une faible dispersion dans l’infrarouge et présente des propriétés de fluorescence et d’électroluminescence, ce qui le rend idéal pour des applications telles que les fenêtres infrarouges, les lasers, les capteurs et les écrans plats.
Structure cristalline du ZnS
Le sulfure de zinc existe sous deux formes : la phase α (structure wurtzite, α-ZnS hexagonal) et la phase β (structure zinc-blende, β-ZnS cubique). La phase cubique est stable à basse température, tandis que la phase hexagonale est la modification à haute température. Le chauffage du ZnS cubique peut entraîner une transformation de phase en ZnS hexagonal. Naturellement, le ZnS est couramment présent sous forme zinc-blende, ce qui le rend abondant dans les ressources minérales. Il est important de noter que le ZnS cubique présente une bande interdite d’environ 3,66 eV, plus large que celle de nombreux semi-conducteurs conventionnels, ce qui le rend adapté aux applications nécessitant une grande transparence dans les régions visible et infrarouge.
Méthodes de synthèse
Différentes approches ont été développées pour obtenir la phase blende de zinc du ZnS, présentant une morphologie contrôlée et une grande pureté :
- Synthèse hydrothermale : Cette technique permet la croissance de cristaux et de microsphères creuses de haute qualité. Les matériaux obtenus présentent souvent une photoluminescence dans les régions bleue et verte, ce qui est précieux pour les applications optiques.
- Synthèse hydrothermale assistée par micro-ondes : En combinant la chimie du solide avec l’irradiation par micro-ondes, les chercheurs peuvent produire rapidement des nanostructures monodisperses présentant une activité catalytique et optique améliorée.
- Synthèse du solide : Le ZnS en phase cubique pure peut être préparé même à température ambiante, présentant un bord d’absorption décalé vers le bleu et une excellente transparence infrarouge.
- Méthodes en phase vapeur : Des techniques telles que le dépôt chimique en phase vapeur (CVD) et le transport chimique en phase vapeur (CVT) sont fréquemment utilisées pour la croissance de couches minces et de monocristaux, ce qui les rend particulièrement adaptées aux dispositifs électroniques et optoélectroniques.
Composés à structure blende de zinc
La structure blende de zinc est largement observée dans de nombreux matériaux technologiques importants. Les semi-conducteurs III-V tels que l’arséniure de gallium (GaAs), l’antimoniure d’indium (InSb), le phosphure de gallium (GaP) et l’antimoniure de gallium (GaSb) cristallisent tous sous cette forme. D’autres exemples incluent le nitrure de bore cubique (c-BN), le carbure de silicium cubique (β-SiC) et les halogénures de cuivre(I) tels que CuCl, CuBr et CuI. La similarité structurelle entre ces composés et le ZnS cubique se traduit souvent par des comportements physiques et électroniques comparables, ce qui est crucial pour la conception de semi-conducteurs.
Avantages
Les composés III-V sont des matériaux semi-conducteurs importants, et le sulfure de zinc cubique, en tant que semi-conducteur II-VI, partage la même structure blende de zinc tout en offrant une bande interdite plus large. Comparé au ZnS hexagonal, le ZnS cubique présente une bande interdite légèrement plus étroite de 3,66 eV, mais elle reste nettement supérieure à celle des semi-conducteurs courants tels que le GaAs et le SiC. De plus, le ZnS cubique pur en phase, sans inclusions hexagonales, présente une excellente transmittance infrarouge. Globalement, le sulfure de zinc cubique présente un fort potentiel dans les domaines des semi-conducteurs et de l’optique infrarouge.
Le sulfure de zinc cubique (ZnS) est non seulement une forme minérale abondante de zinc, mais aussi un matériau semi-conducteur avancé aux propriétés optiques et électroniques exceptionnelles. Grâce à sa structure cristalline en blende de zinc, sa large bande interdite et son excellente transmission infrarouge, il représente un matériau prometteur pour les semi-conducteurs, l’optique infrarouge et les dispositifs optoélectroniques de nouvelle génération.
