Elcloruro de litio, fórmula LiCl, es una sal de litio cristalina blanca muy soluble, delicuescente y de sabor salado. Está clasificado como de baja toxicidad, pero provoca una fuerte irritación y corrosión en los ojos y las mucosas. El cloruro de litio se utiliza ampliamente en metalurgia, desecantes de aire acondicionado y electrolitos de baterías.
Su solución acuosa presenta una fuerte conductividad eléctrica, pero debe almacenarse en un entorno a prueba de humedad y hay que tener cuidado durante su manipulación debido a sus propiedades irritantes. Las siguientes secciones presentan las características básicas y las aplicaciones del cloruro de litio desde varios aspectos.
Qué es el cloruro de litio?
El cloruro de litio es un compuesto cristalino blanco con propiedades delicuescentes. Es muy soluble en agua, etanol y éter, y ligeramente soluble en disolventes orgánicos como acetona, piridina y amoníaco líquido. Aunque su estructura es similar a la del cloruro sódico, los enlaces químicos del LiCl no son los típicos enlaces iónicos, lo que le permite disolverse en una gran variedad de disolventes orgánicos y formar diversos aductos con etanol, metanol y aminas. Esta propiedad hace que el cloruro de litio se utilice habitualmente como medio en procesos de separación para extraerlo de cloruros de metales alcalinos.
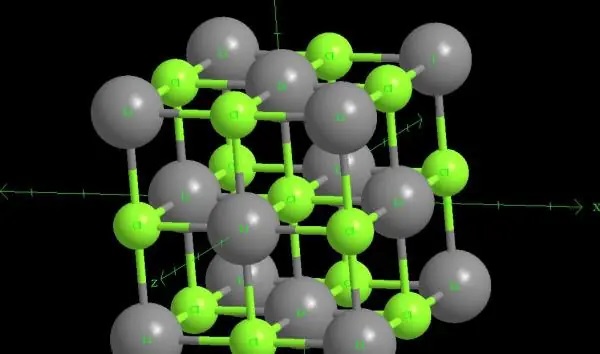
Además, debido al pequeño radio del ion litio y a su elevada energía de hidratación, el cloruro de litio tiene una solubilidad de hasta 83 g/100 mL a 20 °C, muy superior a la de otros cloruros del grupo. Como resultado, su solución acuosa presenta propiedades ligeramente básicas.
Además, el LiCl puede reaccionar con diversas sustancias. Por ejemplo, reacciona con ácido sulfúrico para producir sulfato de litio y cloruro de hidrógeno gaseoso. En el aire, el cloruro de litio absorbe fácilmente la humedad y se delicuesce, por lo que debe almacenarse en un recipiente hermético.
Propiedades básicas
| Parámetros | Valor |
|---|---|
| Fórmula química | LiCl |
| Peso molecular | 42.39 g/mol |
| Densidad | 2.07 g/mL |
| Punto de fusión | 605 °C |
| Punto de ebullición | 1380 °C |
| Índice de refracción | 1.381 |
El cloruro de litio es muy soluble en agua, y su solubilidad aumenta con la temperatura; a 20 °C, aproximadamente 84 g de cloruro de litio pueden disolverse en 100 g de agua. Su solución acuosa es neutra y presenta una buena conductividad eléctrica. El LiCl también posee una gran estabilidad térmica y no se descompone fácilmente en condiciones secas.
Métodos de preparación del cloruro de litio
En la producción industrial, el LiCl se prepara principalmente a partir de minerales de litio o salmueras de lagos salados. Los métodos más comunes son: la extracción a partir de mineral de espodumeno, que se tritura, se tuesta y se hace reaccionar con ácido clorhídrico, seguido de evaporación y cristalización para obtener el producto; o su producción a partir de salmueras de lagos salados mediante procesos de evaporación y separación. Estos procedimientos implican tratamientos tanto físicos como químicos, que requieren un cuidadoso control de la temperatura, la concentración y otros parámetros.
Algunos fabricantes de reactivos producen LiCl anhidro por filtración en caliente de la solución acuosa de LiCl evaporada a 100-110 °C, obteniendo una sal anhidra. Sin embargo, durante este proceso, el calentamiento elimina el agua de cristalización e hidroliza parcialmente el LiCl, provocando una pérdida de HCl y dando lugar a un producto ligeramente básico. La preparación de LiCl anhidro puro requiere métodos más rigurosos, como la deshidratación a presión reducida, el calentamiento conjunto con NH₄Cl y el calentamiento en una corriente de gas de HCl seco hasta 200 °C, o el uso de condiciones sin oxígeno con secado por pulverización de nitrógeno puro.

Qué usos tiene el cloruro de litio?
El cloruro de litio se utiliza principalmente en sistemas de aire acondicionado, como fundente, desecante, reactivo químico y en la producción de fuegos artificiales, pilas secas y litio metálico.
- El cloruro de litio anhidro es una materia prima clave para la producción de litio metálicose utiliza principalmente en los procesos de electrólisis.
- En la industria metalúrgica, sirve como aditivo en la electrólisis del aluminio, ayudando a bajar el punto de fusión y a mejorar la eficiencia.
- En los sistemas de aire acondicionado, las soluciones de cloruro de litio actúan como desecantes, absorbiendo la humedad del aire.
- En la industria de las baterías, se utiliza en la producción de electrolitos de baterías de litio-manganeso, facilitando la conductividad iónica.
- El LiCl también se utiliza en la fabricación de productos farmacéuticos y fuegos artificiales.
- En los laboratorios, se utiliza habitualmente en la investigación biológica y química.
Desarrollo futuro
Con los avances tecnológicos, las aplicaciones del cloruro de litio pueden expandirse a nuevos campos, como el almacenamiento de energía y la ciencia de materiales. Como compuesto versátil y común, el LiCl sigue desempeñando un papel importante en aplicaciones tanto industriales como de investigación.
